临床试验发展迅猛 新药研发势头喜人
——我国新药注册临床试验进展情况分析
发布日期:2022-06-30 阅读次数:15512 来源:中国医药报
摘要:

近日,国家药监局药品审评中心(以下简称药审中心)发布《中国新药注册临床试验进展年度报告(2021年)》,这是药审中心继2021年11月发布《中国新药注册临床试验现状年度报告(2020年)》后,发布的第二份新药注册临床试验情况年度报告。该报告根据药物临床试验登记与信息公示平台的新药临床试验登记信息,对2021年我国新药注册临床试验现状进行汇总分析,为新药研发、资源配置和药品审评审批提供了参考。
本文结合两份报告内容,分析近年来我国新药注册临床试验数据变化情况。
新药临床试验项目数量再攀新高
近年来,为推进药品高质量发展,更好地满足临床需要,我国持续深化药品审评审批制度改革,出台了一系列措施鼓励药品创新,各药企也在政策利好下积极投入创新研发。
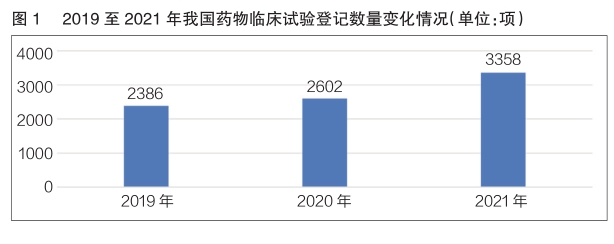
数据显示,2019至2021年,我国药物临床试验登记数量呈逐年增长趋势(详见图1)。2021年我国药物临床试验年度登记总量首次突破3000项,共计3358项。其中,新药临床试验登记2033项,占比60.5%,较2020年同比增长38.0%。
化学药物和生物制品创新势头强劲
2021年,化学药物、生物制品和中药的新药临床试验登记数量占比分别为52.6%、43.6%和3.8%,对比2019至2021年三年数据,均为化学药物新药临床试验登记数量占比最多,生物制品新药临床试验数量占比呈逐年增长趋势(详见图2)。
从新药临床试验的注册分类看,化学药物和生物制品创新势头强劲。
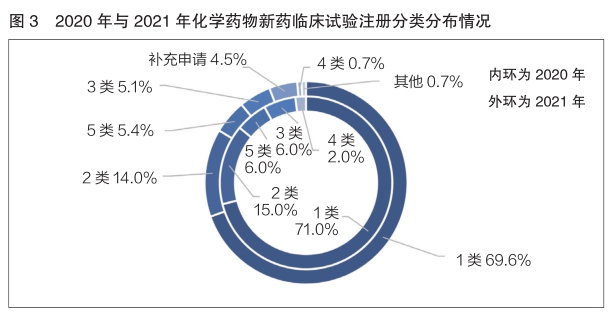
2020年与2021年登记的化学药物新药临床试验均以1类为主,分别占比71.0%和69.6%,基本持平(详见图3)。
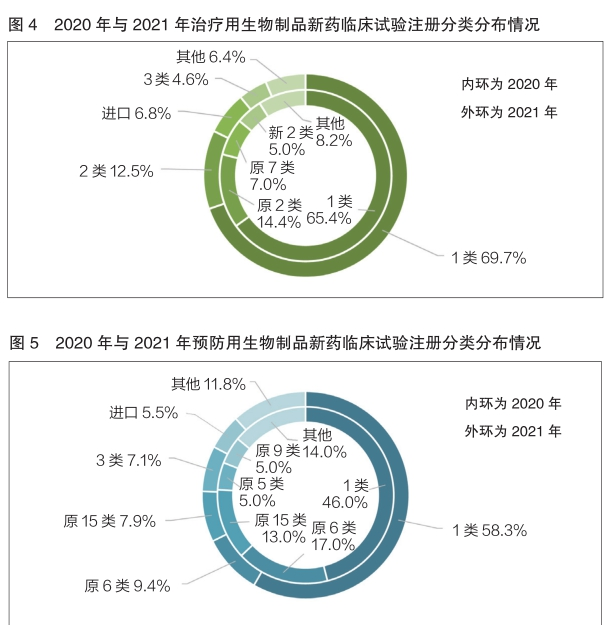
2020年与2021年登记的生物制品新药临床试验同样以1类为主。其中,在治疗用生物制品的新药临床试验中,2020年与2021年1类占比分别为65.4%和69.7%,基本持平;在预防用生物制品的新药临床试验中,2021年1类占比为58.3%,相较于2020年的46.0%有所增长(详见图4和图5)。
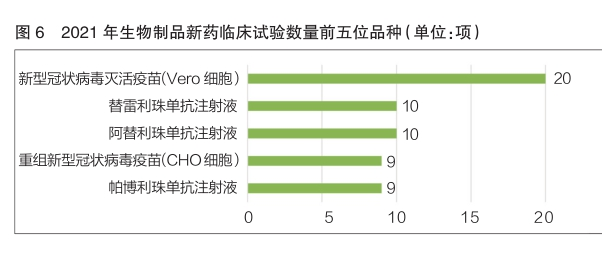
近三年来,新型冠状病毒疫苗成为生物制品的研发热点。2021年新型冠状病毒灭活疫苗(Ver o细胞)开展临床试验20项,是生物制品中新药临床试验数量最多的品种;重组新型冠状病毒疫苗(CHO细胞)也开展了9项临床试验,在生物制品新药临床试验数量排名中位列第四(详见图6)。
抗肿瘤药物研发蓬勃发展
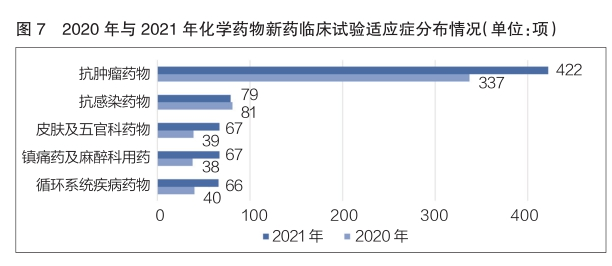
2021年,化学药物新药临床试验数量排名前五位的适应症依次为抗肿瘤药物、抗感染药物、皮肤及五官科药物、镇痛药及麻醉科用药、循环系统疾病药物。其中,抗肿瘤药物以422项新药临床试验位居榜首,相较于2020年的337项,同比增长了25.2%(详见图7)。
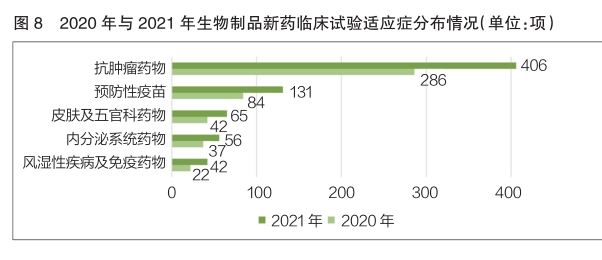
2021年,生物制品新药临床试验排名前五的适应症依次为抗肿瘤药物、预防性疫苗、皮肤及五官科药物、内分泌系统药物、风湿性疾病及免疫药物。其中,抗肿瘤药物新药临床试验数量位居第一,为406项,相较于2020年的286项,同比增长了42.0%(详见图8)。
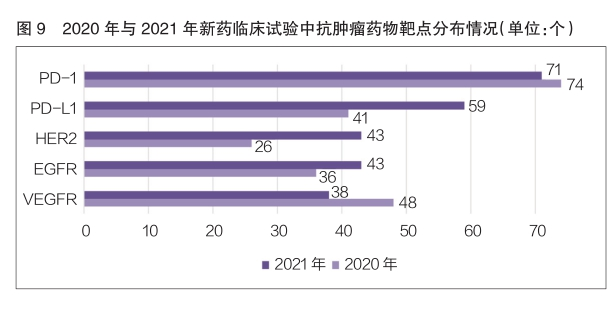
2021年,新药临床试验中抗肿瘤药物的作用靶点主要为PD-1和PDL1。其中,作用靶点为PD-1的品种数量排名第一,为71个,与2020年的74个基本持平;其次是作用靶点为PD-L1的品种,数量为59个,相较于2020年的41个,同比增长了43.9%(详见图9)。
儿童、罕见病用药新药临床试验增多
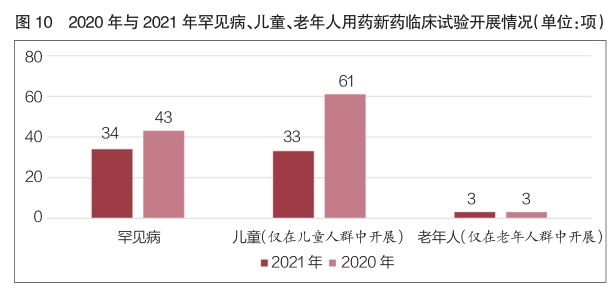
2021年,罕见病新药临床试验共登记43项,较2020年同比增长26.5%。含儿童受试者的新药临床试验168项,在新药临床试验登记总量中占比8.3%;其中仅在儿童人群中开展的新药临床试验61项,在新药临床试验登记总量中占比3.0%,数量较2020年同比增长84.8%。含老年人受试者的新药临床试验共1515项,在新药临床试验登记总量中占比74.5%,占比与2020年基本持平;其中仅在老年人群中开展的新药临床试验与2020年同为3项,适应症分别为帕金森病、成人内源性生长激素分泌不足和轻中度阿尔茨海默病(详见图10)。
相关新闻
美欧日医疗器械监管法律制度概览与思考
2000年,中华人民共和国国务院令第276号公布了《医疗器械监督管理条例》(以下简称《条例》),构建了医疗器械法律制度的框架,我国医疗器械走上了依法治理的轨道。此后《条例》历经多次修订和修改。2021年施行的新版《条例》贯彻“四个最严”要求,全面落实党中央、国务院关于医疗器械审评审批制度改革精神,为鼓励医疗器械产业创新高质量发展提供了坚实的法治保障。
11393个小时之前
最畅销的基因与细胞疗法TOP10盘点
2017年是细胞和基因治疗领域具有里程碑意义的一年,在这一年里,美国食品和药品监督管理局(FDA)批准了首款CAR-T细胞疗法(Kymriah)上市,还批准了首款AAV基因疗法(Luxturna)上市。
11735个小时之前
检查员说 | 浅谈药物警戒检查后企业整改常见问题及解决办法
自2021年12月1日《药物警戒质量管理规范》(以下简称GVP)实施后,截至2023年底,笔者所在的北京市药品不良反应监测中心针对药品上市许可持有人开展了107家次GVP符合性检查。检查员在督促企业整改过程中,常常发现企业不能一次性完成整改,一些问题不能及时纠正,大大降低了检查整改工作效率。现对药物警戒检查后企业整改后出现的常见问题进行梳理并提出相关建议。
11735个小时之前
降脂“药王”缩水76亿,3款新药大涨超100%!海正、鲁南、京新独家产品突围
血脂调节剂是心脑血管系统药物中重要的品类之一,也是首批被国采盯上的临床常用药物。经历了国采五年时间,该类药物的市场规模大幅缩水,2020年至今在中国公立医疗机构终端已无百亿品种,新上市产品则持续爆发活力。2023年信达生物的托莱西单抗注射液获批,成为近年来首个上市的血脂调节剂生物药1类新药,打破了进口药独占市场的局面,君实、康方、恒瑞的PCSK9抑制剂正在冲刺上市,国内血脂调节剂市场又将迎来新局面。
11848个小时之前
中药企业爆发了!28家研发费用超84亿,天士力、以岭、康缘领跑,猛攻4200亿市场
11848个小时之前














