又有23个儿童药鼓励研发,上市后医保、基药目录都支持!(附1-5批名单)
发布日期:2024-05-30 阅读次数:783 作者:子非鱼 来源: 医药云端工作室
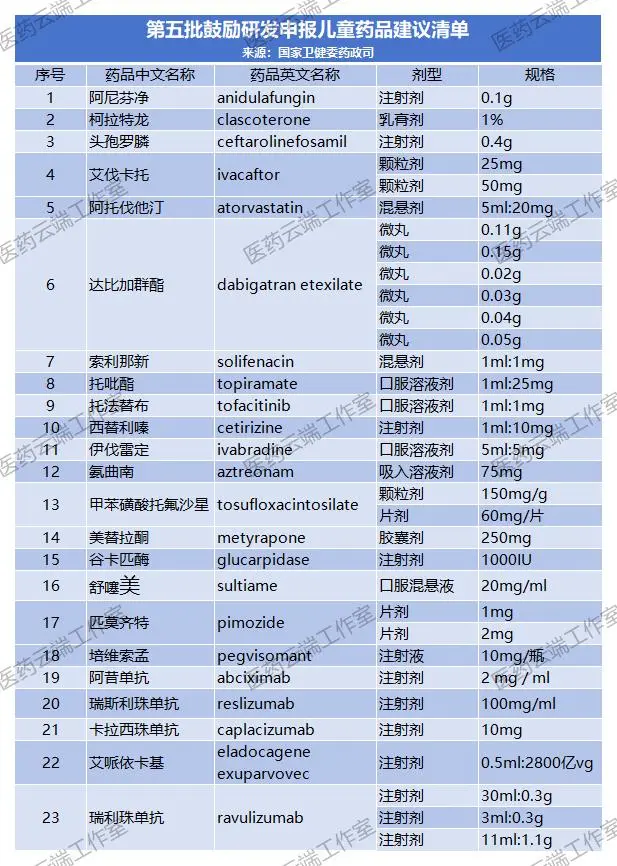
摘要:5月30日,国家卫健委官网公示《第五批鼓励研发申报儿童药品建议清单》,此次公示23个品种,包括阿托伐他汀混悬剂、托法替布口服溶液剂、西替利嗪注射剂、氨曲南吸入溶液剂等,这些品种目前口服常释剂型都早已在国内上市,而混悬剂、口服溶液等剂型还未上市,相信在政策推动下企业加大研发力度可以早日实现临床获益。
5月30日,国家卫健委官网公示《第五批鼓励研发申报儿童药品建议清单》,此次公示23个品种,包括阿托伐他汀混悬剂、托法替布口服溶液剂、西替利嗪注射剂、氨曲南吸入溶液剂等,这些品种目前口服常释剂型都早已在国内上市,而混悬剂、口服溶液等剂型还未上市,相信在政策推动下企业加大研发力度可以早日实现临床获益。(23个公示品种清单见文末)
公示显示,为进一步落实原国家卫生计生委等6部门《关于保障儿童用药的若干意见》要求,丰富儿童适用药品的品种、剂型和规格,满足儿科临床用药需求,2024年,国家卫生健康委、工业和信息化部和国家药监局继续紧密围绕我国儿童疾病谱以及相关企业研发生产能力,组织临床、药学、研发、注册等有关专家结合中国大陆境内尚未注册上市且临床急需的儿童用药现状,基于循证原则筛选论证,提出了《第五批鼓励研发申报儿童药品建议清单》。现予以公示,公示5个工作日。
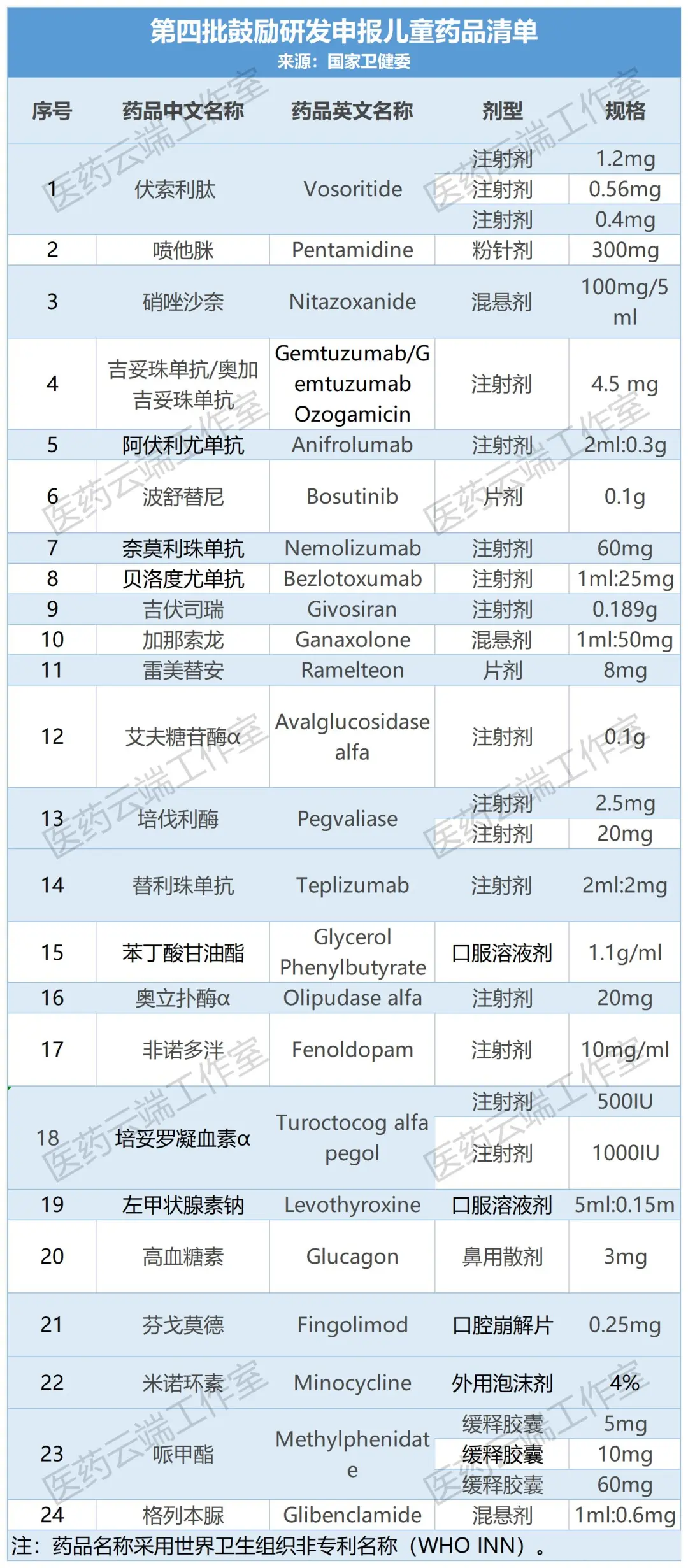
截至今日,我国共公布了四批鼓励研发申报儿童药品清单,共129个品种。(1-4批名单附后)
此项清单由国家卫健委会同科技部、工信部、国家医保局、国家药监局组织,持续围绕我国儿童用药临床需求以及相关企业研发生产能力遴选制定。
为保障儿童基本用药需求,促进儿童用药安全科学合理使用,对于防治儿童疾病、提升儿童健康水平具有重要意义。当前,我国儿童用药适宜品种少、适宜剂型和规格缺乏、药物临床试验基础薄弱、不规范处方行为和不合理用药等问题仍比较突出,亟待采取措施予以解决。
此后,不断完善儿童药物政策,包括出台了鼓励申报研发儿童药建议清单制度。至今已经公布四批共129个药物。此次第五批建议清单在公示后,也会马上进行正式公布。
2024年1月10日,国家卫健委、发改委、医保局、药监局等10部门联合印发《关于推进儿童医疗卫生服务高质量发展的意见》(国卫医政发﹝2024﹞1号 ),该《意见》明确指出,要补齐儿童用药短板:
坚持以儿科临床需求为导向推动药品生产企业研发,加大对儿童用药品种及关键技术研发的支持力度,补齐儿童药物适宜剂型、规格不足等短板。加强儿童药品使用监测,动态调整包括儿童用药在内的短缺药品清单和临床必需易短缺药品重点监测清单,加强易短缺药品生产及供应链监测预警。深化供应链协作,推动儿童药重点品种原料药与制剂一体化发展。按照国家规定的已上市药品说明书增加儿童用药信息工作程序有关要求,支持符合条件的儿科相关医疗机构按程序提出增加药品说明书儿童用药信息的建议。充分运用药品加快上市注册程序,对符合儿童生理特征的儿童用药品予以优先审评审批。
《意见》在儿童药遴选和配备方面,也对给予了政策支持:
加强医疗机构儿童用药遴选和配备管理,强化医师处方、药师审方、护士给药及药品临床综合评价等各环节管理,提高合理用药水平。支持儿科的医院制剂依法依规在医联体内使用,对医疗机构应用传统工艺配制中药制剂实施备案管理。
此外,《意见》在完善儿童医疗保障待遇和支付政策方面,也提出诸多医保政策优惠条件,包括居民医保慢特病保障、医保药品目录调整向儿童药倾斜、实施DRG/DIP要考虑儿科因素,优化分组、权重和分值:
有条件的地方可根据经济社会发展水平、基金承受能力和当地保障需求,将儿童治疗周期长、健康损害大、费用负担重的疾病门诊费用纳入居民医保慢性病、特殊疾病保障范围。医保目录调整向儿童用药予以倾斜。科学制定医保总额,合理考虑按病种、按床日、按人头等付费方式中的儿科因素。在开展按疾病诊断相关分组、区域点数法总额预算、按病种分值付费试点时,充分考虑儿科疾病特点,优化疾病分组、权重、分值计算。
遴选儿童用药(仅限于药品说明书中有明确儿童适应证和儿童用法用量的药品)时,可不受“一品两规”和药品总品种数限制,进一步拓宽儿童用药范围。开展儿科医疗服务的二级以上医疗机构要在本机构药事管理与药物治疗学委员会下成立儿童用药工作组。
儿童用药与基药、集采中选品种、国谈品种类似,成为医院准入能够突破一品两规和医院总数限制的“特权品种”,足见国家对该类药物的重视和支持。
国家鼓励研发的儿童药物是医保调整的重点对象之一
此外,纳入国家鼓励研发申报儿童药品清单的药物,也是医保目录调整重点支持的品类。比如,最新的2023年医保药品目录调整方案中,明确将其纳入调整对象,企业可以申报。如下图所示:

新版基药目录调整将有儿童药的一席之地
据国家卫健委2023年3月21日在其官网公开的《对十三届全国人大五次会议第1094号建议的答复》内容显示,新版基药目录将考虑儿童药物的纳入,并拟对综合医院、儿童专科医院等加强儿童用药的遴选购用进行规定,要求医院对儿童用药单列目录,并做好其临床使用管理。
(一)关于选择入选儿童基本药物目录的药品。近年来,我委借鉴国际儿童基本药物目录经验,结合我国儿童特点、临床需求和保障现状,开展制定儿童基本药物目录必要性和可行性研究。在修订《国家基本药物目录管理办法》中,提出国家基本药物包括化学药品和生物制品、中药和儿童药品等,已向社会公开征求意见。此外,梳理我国现有儿童药品信息,组织儿童基本药物目录管理机制研究,您所提相关的建议内容也是我委研究论证、分析研判的内容之一。
(二)关于倡议提高“儿童用药”的临床地位。我委高度重视儿童药品的临床使用。目前,正在研究起草加强儿童用药临床管理的相关文件,拟对综合医院、儿童专科医院等加强儿童用药的遴选购用进行规定,要求医院对儿童用药单列目录,并做好其临床使用管理。此外,在组织开展儿童基本药物目录管理机制研究中,也涉及您提到的工作流程、优先政策等建议内容。
近年来儿童药领域取得的成就及政策
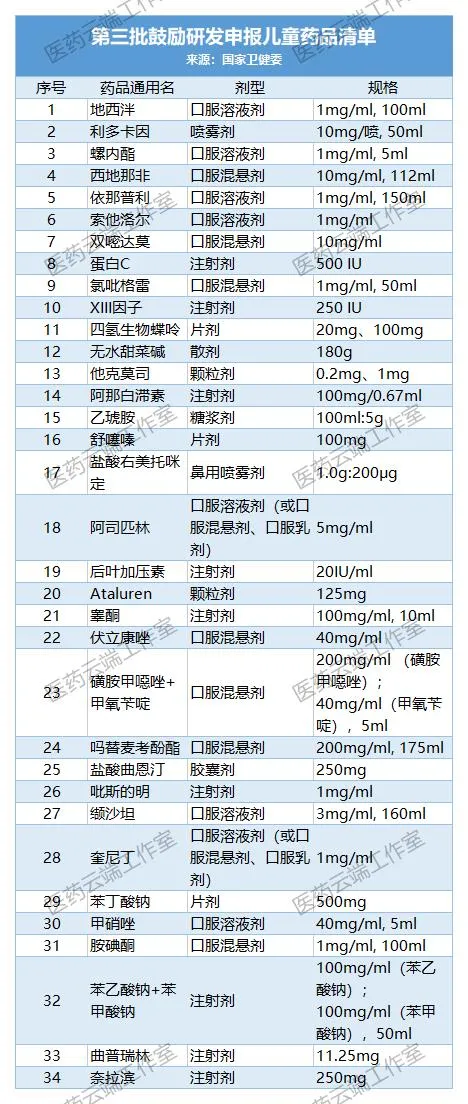
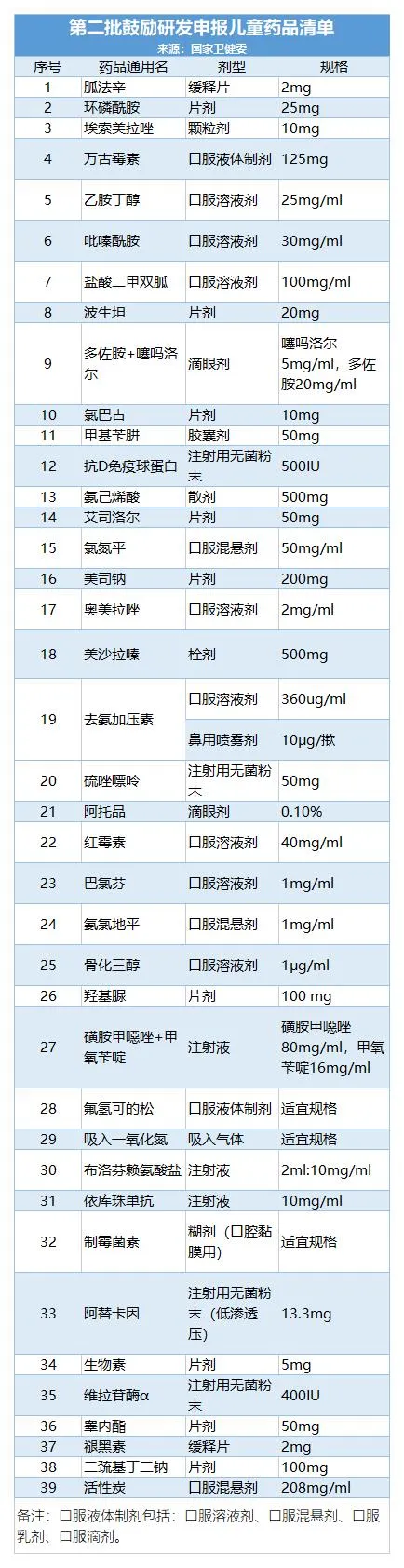
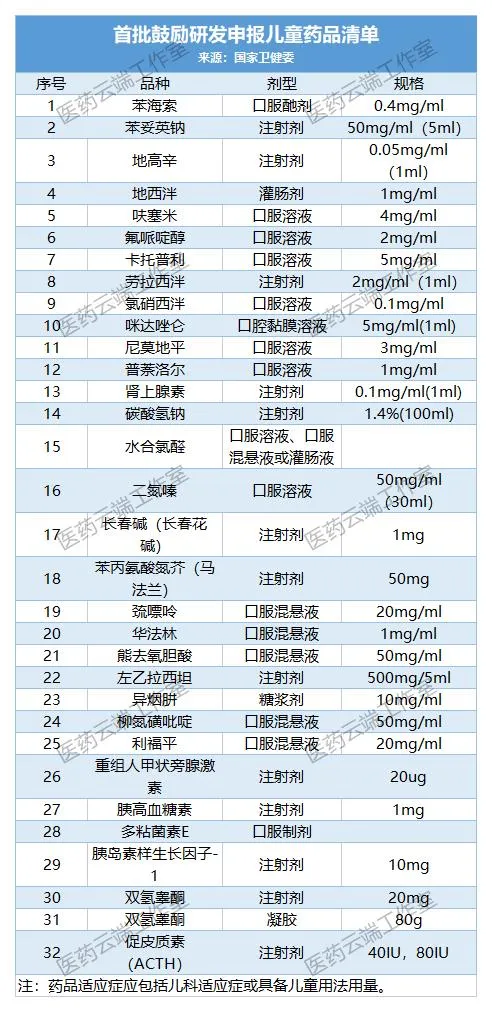
 附:第1-4批儿童药清单
附:第1-4批儿童药清单
相关新闻
复星医药:子公司复迈替尼片注册申请受理
6月6日,复星医药公告称,公司控股子公司上海复星医药产业发展有限公司自主研发的复迈替尼片用于治疗2岁及2岁以上儿童1型神经纤维瘤病(NF1)相关的丛状神经纤维瘤(PN)的药品注册申请于近日获国家药监局受理并已被纳入优先审评程序。
10084个小时之前
国家药监局部署加强医疗器械临床试验机构监管
10084个小时之前
在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则发布
近日,国家药监局药品审评中心(以下简称药审中心)发布《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》(以下简称《指导原则》)。《指导原则》自发布之日起施行。
10129个小时之前
2024年全国药品抽检中期工作会召开
10129个小时之前
全国疫苗监管质量管理体系建设工作交流会召开
10129个小时之前














